可视化检测活细胞中低含量的生物分子在分子生物学和疾病诊断方面具有非常重要的意义。此类探针不仅需要能够自主穿过细胞膜屏障,并且在细胞环境中保持稳定。基于金纳米颗粒构建的纳米耀斑探针(Nanoflare)是此类探针的典范。为了改善该探针的精确度,王柯敏团队在2015年发展了一种基于荧光共振能量转移的纳米耀斑探针(FRET Nanoflare),不仅消除了假阳性信号,而且最大程度降低了系统误差带来的干扰(JACS, 2015, 137, 8340; Anal. Chem., 2015, 87, 8724)。但是该探针仍局限于“一对一”信号触发模式(一个靶标触发一个信号),用于成像活细胞内某些低丰度靶标可能会导致检测灵敏度不足等问题。因此迫切需要开发有效的“一对多”模式(一个靶标触发多个信号)用于灵敏成像活细胞中低丰度靶标。
近日,湖南大学王柯敏和黄晋团队在化学顶级期刊Angew. Chem. Int. Ed.上发表研究论文,报道了一种放大的基于荧光共振能量转移的纳米耀斑探针(Amplified FRET Nanoflare):利用细胞内高丰度内源性mRNA作为燃料分子驱动纳米机器在活细胞内自动运行,从而实现细胞内低丰度miRNA的放大成像(图1)。该探针可以有效地避免外加物对反应体系的破坏,同时简化操作过程。除此之外,该设计以荧光共振能量转移(FRET)为比率型输出信号有效地降低了由于系统波动或者化学干扰带来的假阳性信号,同时由于高丰度mRNA的参与,无论是在试管中还是在细胞内对特定miRNA的检测都表现出很高的灵敏度和特异性以及在复杂环境中的抗干扰能力。该论文第一作者为博士生李静,通讯作者为黄晋教授和王柯敏教授。

图1. miRNA触发、mRNA驱动放大的FRET纳米耀斑探针的工作机理。
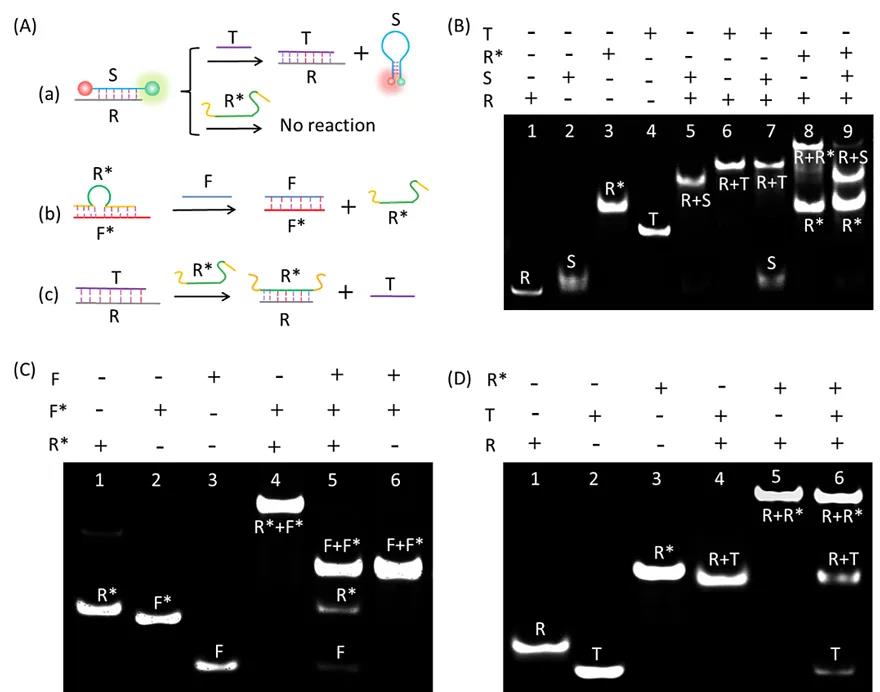
图2.电泳分步验证T触发、F驱动的放大纳米耀斑的可行性。
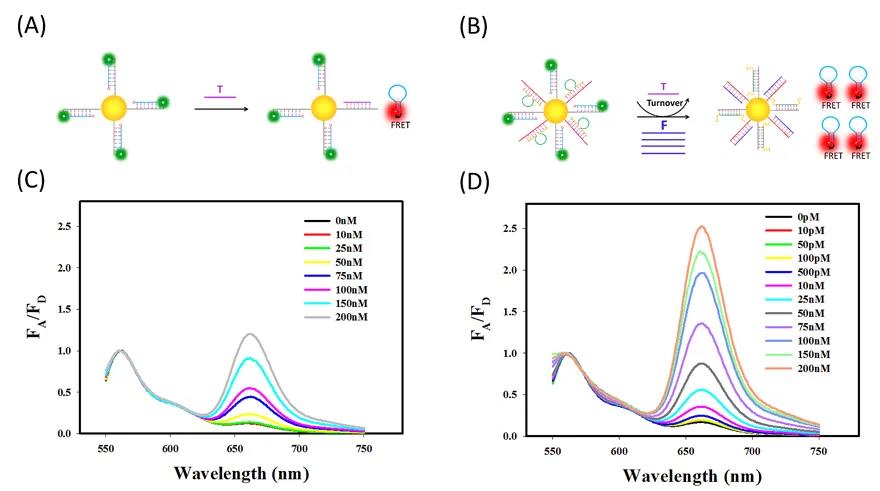
图3.荧光考查T触发、F驱动的放大FRET纳米耀斑的放大性能。
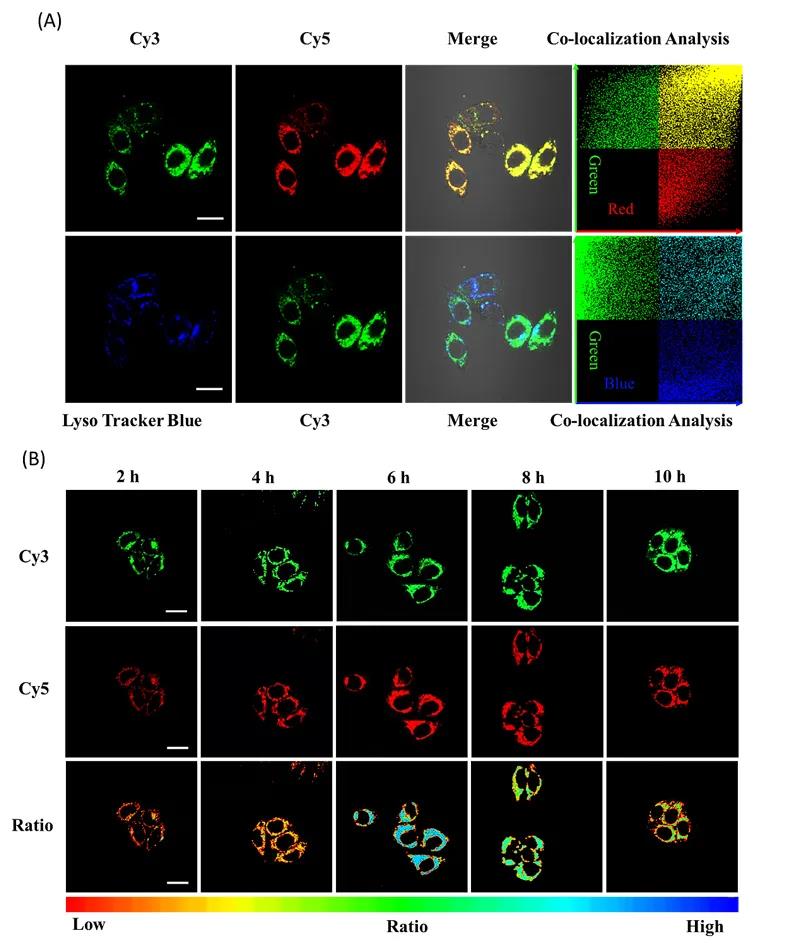
图4.共聚焦成像T触发、F驱动的放大FRET纳米耀斑在细胞内的分布情况以及成像时间考查。
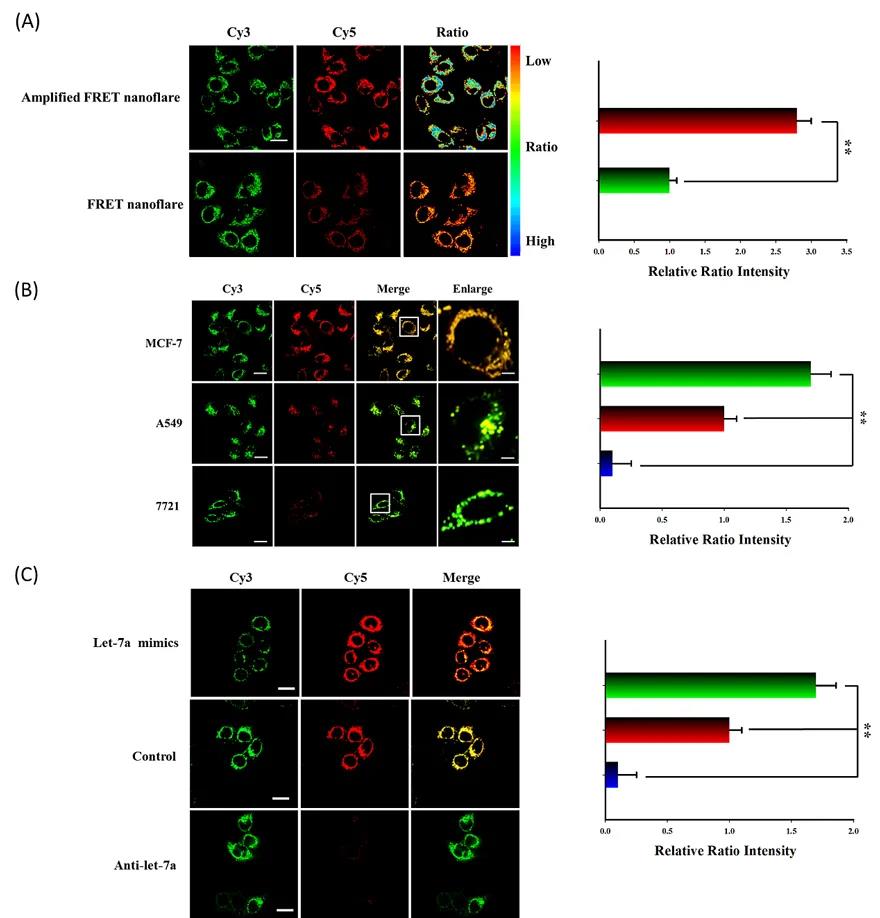
图5.共聚焦荧光成像细胞内放大FRET纳米耀斑。
综上所述,该纳米机器可以借助内源性mRNA的驱动在活细胞内自动运行不需要外加辅助物即可实现对特定miRNA的放大成像。与不放大的同类型探针相比,其灵敏度降低了三个数量级。可以展望,如果将细胞内或血管中不同的高丰度分子作为燃料分子,借助于与之相对应的识别分子,我们可以设计不同功能的纳米机器在活细胞或者血管中去执行不同的任务。
来源:X一MOL资讯
责任编辑:东辰
