近日,湖南大学分子科学与生物医学实验室(MBL)研究报道了一种膜锚定的DNA纳米平台,可用于精确控制APC-T细胞接触区的膜间距离以深入研究T细胞信号转导的分子机制。相关研究成果以题为“Membrane-anchored DNA nanojunctions enable closer antigen-presenting cell–T-cell contact in elevated T-cell receptor triggering”(DOI:10.1038/s41565-023-01333-2)的研究论文在国际顶级期刊《Nature Nanotechnology》在线发表。
众所周知,T细胞介导的适应性免疫在对抗许多疾病中发挥着至关重要的作用。该过程是由T细胞表面受体(TCR)与抗原呈递细胞(APC)表面的抗原肽-主要组织相容性复合物(pMHC)结合所启动。在TCR与pMHC结合后,TCR复合物胞内结构域中的免疫受体酪氨酸基激活基序(ITAM)将被Src家族的酪氨酸激酶Lck磷酸化,导致激酶ZAP-70的募集和激活,进而磷酸化衔接蛋白LAT,以触发下游信号级联反应,最终导致T细胞的活化。在T细胞活化这样一个由多种分子参与并发生相互作用的复杂过程中,尽管TCR与pMHC结合起着重要作用,但关于TCR-pMHC具体如何参与启动细胞内信号级联的分子机制仍存在争议。
TCR与pMHC连接后,会招募多个辅助分子以在APC和T细胞相互作用的界面处形成紧密接触区域。TCR-pMHC复合物的尺寸约为13 nm,意味着APC-T细胞接触区的轴向距离维持在一个很小的尺度。此前已有报道通过延长pMHC配体及其他蛋白研究了接触区域的空间因素对TCR信号通路的影响。但这些策略难以测量膜间距离和TCR信号通路之间的线性关系,并且涉及蛋白质结构和表达的变化,可能会导致相互矛盾的结果。人工制造的纳米界面能够提供可测量的模型,但它们在许多固有的膜相关分子和适应性形态方面存在缺陷,不可避免地导致其在代表真实APC方面的局限性。此外,简化模型虽然更易研究,但想要实现对这一复杂生物过程相对全面的了解仍面临巨大挑战。迄今为止报道的策略仅侧重于延长膜间间隔,很少有人试图探索压缩膜间距离这一操作所产生的影响,这在机制研究中不可避免地留下了空白。
有鉴于此,谭蔚泓教授和邱丽萍教授团队通过将胆固醇标记的DNA四面体(TDN)作为细胞膜锚定支架构建出不同尺寸的DNA纳米连接子(DNJ),在真实的T细胞和树突状细胞(DC)相互作用体系中对TCR-pMHC介导的接触区域的轴向空间距离进行延长、维持和压缩操作,在保持细胞自然生理状态的前提下,探讨T细胞活化过程的分子机制。

图1. DNJ精确操纵DC-T细胞紧密接触区的轴向距离。
基于这种可编程的膜锚定DNA纳米平台,该研究首次在真实的DC-T细胞相互作用体系中,实现了TCR-pMHC周围紧密接触区轴向空间距离的精准测量和调控。该研究表明在临界低表面密度下,尺寸超过TCR-pMHC复合物尺寸的DNJ-37可以通过延长膜间距离削弱CD45分离来抑制T细胞激活信号,小尺寸的DNJ-7能够压缩DC-T细胞界面处的膜间间隔,并通过导致CD45严格外排和TCR构象改变实现T细胞活化的强烈增强。这些研究结果为紧密接触区的轴向尺寸在T细胞触发中的重要作用提供了直接证据,并且通过缩短DC-T细胞界面可以显著增强T细胞活化水平,为T细胞免疫研究拓宽了窗口。此外,该研究开发的膜锚定DNA纳米平台,具有高可编程性、高可控性、方便操作和良好的生物相容性等优势,有望为细胞-细胞相互作用过程中的分子事件研究提供新范式。
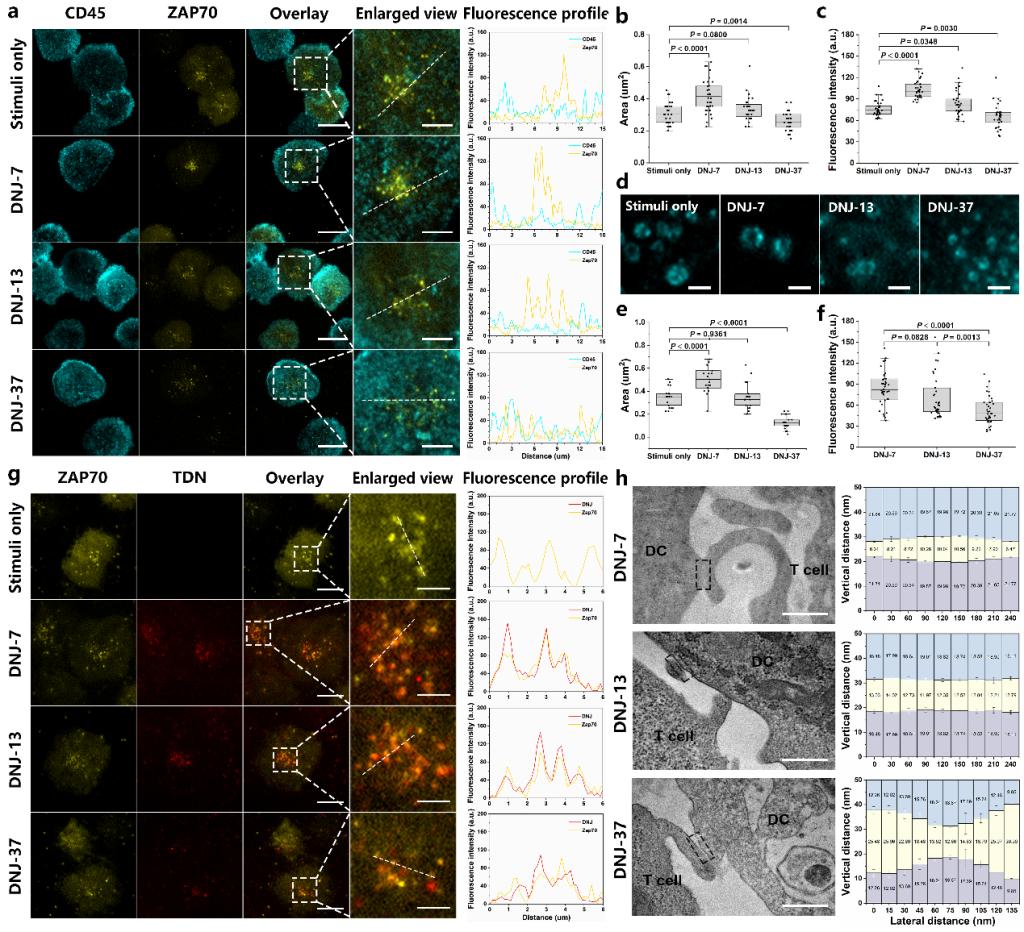
图2. T细胞受体信号传导的分子机制研究。
湖南大学分子科学与生物医学实验室(MBL)、化学生物传感与计量学国家重点实验室、化学化工学院谭蔚泓教授和邱丽萍教授为该工作的通讯作者,湖南大学化学化工学院博士生堵玉林和吕一帆副教授为该工作的第一作者。该工作得到了来自国家重点研发计划、国家自然科学基金、湖南省科技创新项目、深圳市优秀科技创新人才培养项目等项目的资助。
来源:化学化工学院
通讯员:堵玉林
责任编辑:蒋鼎邦
