一直以来,人类利用完整的微生物细胞作为催化体系来制备所需的产品,例如酿酒、酿醋和酸奶制作均已有了数千年的历史。近年来,人工金属酶(ArM)技术的发展为全细胞催化剂赋予了更强大的催化能力。然而,人工金属酶与全细胞催化剂的联用面临两大挑战,一是人工金属酶对环境高度敏感,二是人工金属酶本身在细胞内的组装(蛋白和非生物辅因子的连接过程)较为困难。
近日,湖南大学化学化工学院白玉罡教授课题组报道了一项突破性研究成果。该课题组成员利用液-液相分离(LLPS)技术,在大肠杆菌中创建出了由蛋白构成的人工隔室,为人工金属酶提供稳定的“庇护所”,从而成功开发了具备高活性和高稳定性的全细胞催化剂。这一技术被称为ArM-LLPS技术,它不仅能大幅提升单细胞催化效率,还在罹患结肠癌的小鼠模型中实现了靶向催化-原位产药过程,为癌症治疗提供了全新的潜在解决方案。
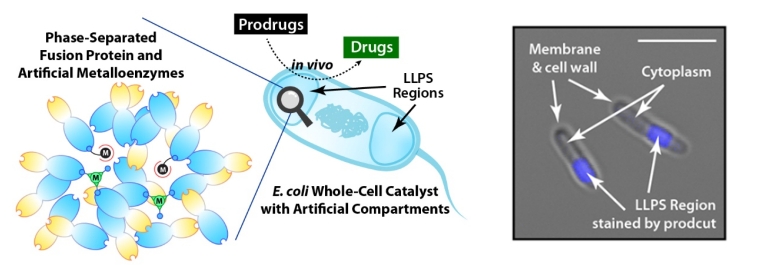
左:通过LLPS技术在大肠杆菌中创建人工隔室总示意图。人工金属酶与支架蛋白通过液-液相分离在大肠杆菌内形成人工隔室,创造出“庇护所”以提高其内部的人工金属酶的催化效率,由此构建出了具有高性能的大肠杆菌全细胞催化剂。在体内环境中,这些全细胞催化剂能够在特定位置将前药(Prodrugs)转化为活性药物(Drugs)。右:显微镜图像显示全细胞催化“庇护所”中经人工金属酶催化生成的荧光产物(蓝色)。
在实验中,团队成功在LLPS隔室内的HS蛋白上构建出了多种人工金属酶,相比传统的周质策略,该技术显著提升了人工金属酶在单细胞中的含量。为验证ArM-LLPS技术的实际应用潜力,团队成员还构建了小鼠结肠癌模型,接受全细胞催化剂与前药组合治疗的小鼠,其治疗效果优于常规药物治疗组,且器官毒性和体重减轻情况大幅改善。这种“基于催化剂的靶向治疗”策略为癌症的靶向治疗提供了新的可能性。综上所述,人工金属酶与LLPS联用的ArM-LLPS技术展现了巨大潜力,可以带来高质、高效的全细胞催化剂系统。
相关研究成果以“Artificial Metalloenzyme Assembly in Cellular Compartments for Enhanced Catalysis”为题发表在国际顶尖期刊《自然·化学生物学》(Nature Chemical Biology)上。白玉罡教授为论文唯一通讯作者,湖南大学为第一通讯单位。化学化工学院博士后吴彤为论文第一作者。该工作得到了国家自然科学基金、湖南省科技厅以及湖南省研究生创新基金等方面的资助。
来源:化工院
通讯员:陈四海
责任编辑:余楚倩
